IA per l'ottimizzazione di molecole terapeutiche e di trattamenti medici di precisione
DOI 10.12910/EAI2025-017
di Nicolò Colistra, Francesca Camera, Paolo Roberto Saraceni, Arianna Casciati, Mirella Tanori, Caterina Arcangeli, Caterina Merla, Dipartimento Sostenibilità, circolarità e adattamento al cambiamento climatico dei Sistemi Produttivi e Territoriali, Laboratorio Biotecnologie Red – ENEA (*)
L'Ia sta rivoluzionando la medicina e le biotecnologie, migliorando l’efficacia terapeutica e accelerando la ricerca di nuovi farmaci. L’ENEA è in prima linea in questo cambiamento, concentrandosi sull'uso dell'IA per ottimizzare trattamenti cardiologici e oncologici e per lo screening di molecole terapeutiche. In questi ambiti, l'IA contribuisce a rendere i protocolli più precisi, economici e, quindi, sostenibili, segnando un progresso significativo per la ricerca e l’applicazione clinica. Questo articolo esplora gli aspetti più significativi della ricerca svolta da ENEA e le loro implicazioni per affrontare le sfide del futuro per il miglioramento della qualità di vita.
L’intelligenza artificiale (IA) non è più solo una tecnologia del futuro: oggi, le sue applicazioni stanno trasformando numerosi settori, tra cui quello biologico, medico e biotecnologico. Un’area in cui l’IA dimostra un potenziale eccezionale è l’ottimizzazione di protocolli complessi che richiedono la gestione contemporanea di numerosi parametri. In questo contesto, la Divisione Biotecnologie del Dipartimento di Sostenibilità, circolarità e adattamento al cambiamento climatico dei Sistemi Produttivi e Territoriali (SSPT), sta conducendo ricerche per migliorare le tecnologie esistenti con un duplice obiettivo: ottimizzare l’efficacia terapeutica e promuovere soluzioni sostenibili in termini di risparmio di risorse.
In particolare, l’attività di ricerca riguarda due aree distinte ma accomunate dall’approccio innovativo. Da una parte vi è l’ottimizzazione di tecnologie terapeutiche basate su impulsi elettrici ultra-brevi, con applicazioni che spaziano dal trattamento di aritmie cardiache a quello di specifiche patologie oncologiche. Dall’altro lato, ENEA utilizza l’IA per lo screening di molecole d’interesse terapeutico e per lo sviluppo di molecole bioattive, un campo di grande importanza nella ricerca farmacologica.
Il continuo sviluppo e l’integrazione dell’IA nella ricerca biomedica e biotecnologica sta avendo quindi un ruolo significativo nell’offrire soluzioni sanitarie precise, personalizzate ed economicamente più accessibili. Grazie a una riduzione di tempi e costi delle procedure, l’IA contribuisce alla sostenibilità complessiva dei sistemi sanitari. Questo articolo esplora gli aspetti più significativi della ricerca svolta da ENEA e le loro implicazioni per affrontare le sfide del futuro per il miglioramento della qualità di vita.
IA per l’ottimizzazione di parametri nei trattamenti cardiaci e oncologici basati su segnali elettrici pulsati ultra-brevi
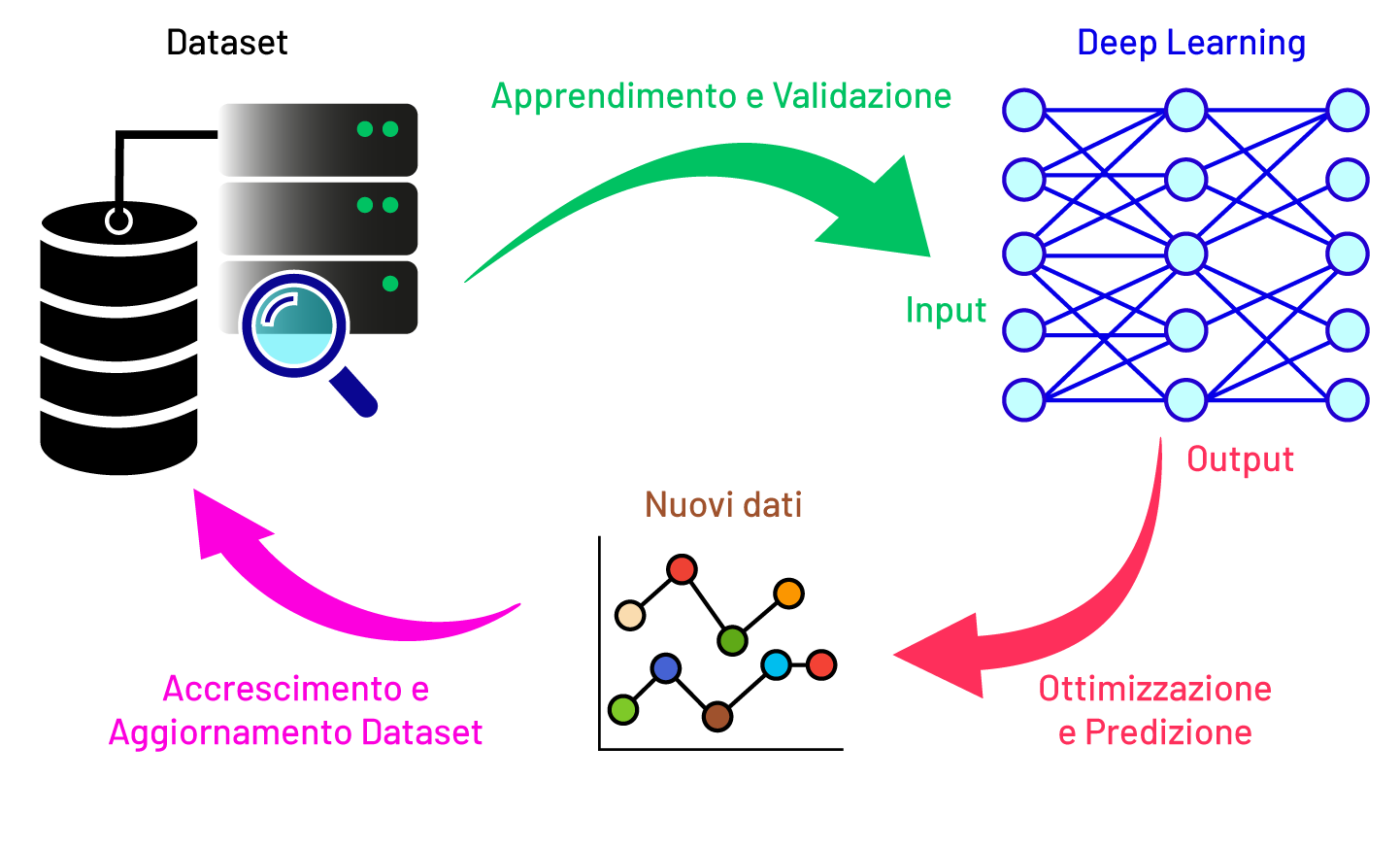
L'ablazione cardiaca basata su impulsi elettrici ultra-brevi è una modalità innovativa che utilizza l’erogazione di impulsi elettrici tramite elettrodi per rimuovere il tessuto aritmogeno, riducendo il rischio di danneggiare i tessuti sani circostanti. Tuttavia, l’efficacia del trattamento dipende da una vasta gamma di parametri, come il tipo e il posizionamento degli elettrodi, l’ampiezza del segnale, la durata degli impulsi, il numero di impulsi e l’area ablata. La scelta dei parametri ottimali basata esclusivamente su esperimenti tradizionali risulta impraticabile. In questo contesto, l’IA permette la predizione dei parametri ottimali tramite l’elaborazione di una gran mole di dati in modo economico, rapido e sostenibile, riducendo significativamente la necessità di sperimentazioni prolungate e costose. L’ENEA ha implementato diverse tecniche di IA, concentrandosi in particolare sul deep learning [1], [2]. Studi comparativi hanno analizzato reti neurali progettate per ottimizzare un singolo parametro e quelle in grado di gestirne molti contemporaneamente. I risultati sono stati molto promettenti: i modelli multiparametrici si sono dimostrati molto efficaci nell’accelerare il processo di ottimizzazione, e, grazie alla loro versatilità e praticità, offrono un grande potenziale per il trasferimento in ambito clinico.
L’IA trova applicazione anche in ambito oncologico. L’elettrochemioterapia è un trattamento volto a potenziare l’efficacia della chemioterapia utilizzando impulsi elettrici per rendere le cellule cancerose più permeabili, favorendo quindi l’ingresso del chemioterapico. L’ENEA, nell’ambito delle sue ricerche, ha sviluppato un approccio alternativo che combina l’uso degli impulsi elettrici con la radioterapia, uno dei “gold-standard” tra i trattamenti oncologici. È stato infatti dimostrato che l’applicazione di impulsi elettrici seguiti dalle radiazioni ionizzanti (raggi X) ne aumenta l’efficacia, con il vantaggio di ottenere lo stesso effetto terapeutico ma riducendo le dosi di radiazione ionizzante da somministrare [3]. L’ottimizzazione di questi protocolli per la terapia combinata è uno dei principali obiettivi della ricerca condotta dall’ENEA, in particolare per adattare i trattamenti a diversi tipi di tumori che presentano specifiche caratteristiche molecolari. Tra le altre variabili da ottimizzare vi sono le tempistiche dei trattamenti (ovvero l’intervallo che deve intercorre tra l’applicazione gli impulsi elettrici e le radiazioni) e l’individuazione delle dosi ottimali delle radiazioni stesse. Anche in questo contesto, gli algoritmi di IA basati sul deep learning, grazie alla loro capacità di analizzare grandi quantità di dati, si sono rivelati uno strumento prezioso, per l’ottimizzazione dei parametri in ogni specifico caso, aprendo la strada a trattamenti oncologici più personalizzati ed efficaci.
IA per lo screening di molecole terapeutiche
L’IA si sta affermando anche nel settore farmaceutico nell’identificazione di nuove molecole terapeutiche, ovvero molecole in grado di riconoscere, legare e attivare o inibire un determinato bersaglio cellulare. Di solito, il processo di screening è complesso, lungo e costoso, poiché si basa principalmente su un elevato numero di esperimenti di laboratorio. Sebbene tecniche computazionali come il “docking” molecolare e la dinamica molecolare, che simulano rispettivamente le diverse configurazioni di legame tra le molecole e le loro interazioni nel tempo, siano un valido supporto, non sempre riescono a rappresentare adeguatamente la complessità e la variabilità delle interazioni reali [4], [5], [6].
Una strategia adottata in ENEA per superare tali limitazioni consiste nell’integrazione dell’IA con queste tecniche di simulazioni in silico. Queste simulazioni avanzate permettono di generare milioni di diverse configurazioni dell’interazione tra la molecola terapeutica e il bersaglio cellulare. L’IA viene impiegata per analizzare l’enorme quantità di dati generata, e, grazie a modelli avanzati, come il “machine learning” geometrico, è possibile prevedere con precisione come le molecole si legano tra loro, analizzare le variazioni della loro struttura e identificare le condizioni ottimali per un’interazione molecolare efficace. Questo approccio computazionale, efficace nell’identificazione delle molecole più promettenti, permette di ridurre la sperimentazione necessaria per la validazione finale di una possibile molecola terapeutica. In questo modo, l’IA non solo accelera il processo di scoperta di nuove molecole e quindi di farmaci, ma ne migliora la precisione d’azione, contribuendo allo sviluppo di trattamenti più mirati, sicuri ed efficaci.
Bibliografia
[1] M. Zappatore, et al., IEEE Microw. Mag., vol. 22, no. 9, pp. 42–59, Sep. 2021, doi: 10.1109/MMM.2021.3086316.
[2] A. De Cillis, et al., IEEE J. Electromagn. RF Microw. Med. Biol., vol. 8, no. 3, pp. 220–228, Sep. 2024, doi: 10.1109/JERM.2024.3378573.
[3] M. Tanori et al., Int. J. Radiat. Oncol., vol. 109, no. 5, pp. 1495–1507, Apr. 2021, doi: 10.1016/j.ijrobp.2020.11.047.
[4] C. Arcangeli, et al., Int. J. Nanomedicine, vol. 14, pp. 10123–10136, Dec. 2019, doi: 10.2147/IJN.S225793.
[5] G. Innamorati, et al., J. Biomol. Struct. Dyn., vol. 41, no. 5, pp. 1586–1602, Mar. 2023, doi: 10.1080/07391102.2021.2023642.
[6] C. Lico et al., Int. J. Mol. Sci., vol. 22, no. 19, Art. no. 19, Jan. 2021, doi: 10.3390/ijms221910523.
Note
(*) Collaborazioni: Dipartimento di Ingegneria per l’Innovazione (Università del Salento, Lecce, LE), IGEA S.p.A. (Carpi, MO), Takis s.r.l. (Roma, RM) nell’ambito del Joint Lab “Match” di Rome Technopole (ECS 0000024 CUP.B83C22002820006, PNRR Mission 4 Component 2 Investment 1.5, funded by European Union – NextGenerationEU)